Канабіноїди в контексті російсько-української війни: чи міг би канабіс покращити ментальний стан українців в умовах повномасштабного вторгнення?
-
14 серпня 2025Переглянуто: 4961
Вступ
У контексті триваючої війни й зростаючих викликів психічному здоров’ю в Україні, особливо гостро постає питання пошуку нових засобів підтримки людей, які пережили психотравмуючі події серед ветеранів і тих, хто не брав участі у бойових діях. Доказова база доклінічних та початкових клінічних досліджень свідчить про значний терапевтичний потенціал канабіноїдів у зменшенні симптомів ПТСР, тривоги та порушень сну – тими проблемами, з якими українці масово стикаються упродовж повномасштабної російської агресії. То чи може канабіс, хоча б частково, стати інструментом для збереження ментального здоров’я людей, що постраждали від війни? В цій статті я спробую дати максимальний об’ємну відповідь на це болюче, втім актуальне питання.
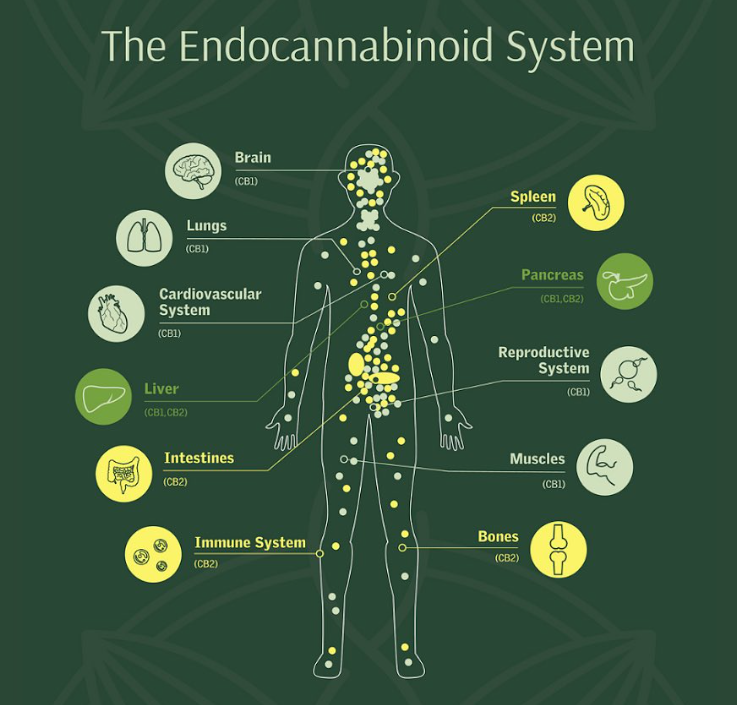
Що таке ендоканабіноїдна система?
Подальші дослідження вказують на те, що ЕКС не обмежується лише короткотривалими змінами — вона також залучена до більш тривалих форм синаптичної пластичності, таких як довготривале потенціювання (LTP) і депресія (LTD), у багатьох ділянках мозку, включно з гіпокампом, амігдалою та префронтальною корою. Саме ці зміни лежать в основі навчання, емоційної регуляції та пам’яті (Maldonado et al., 2006; Di Marzo, 2009; Sidhpura & Parsons, 2011; Bitencourt & Takahashi, 2018).
Таким чином, ендоканабіноїдна система постає як потужний модуль регуляції нейрофізіології мозку — від етапів його розвитку до найтонших налаштувань емоційного досвіду та пам’яті.
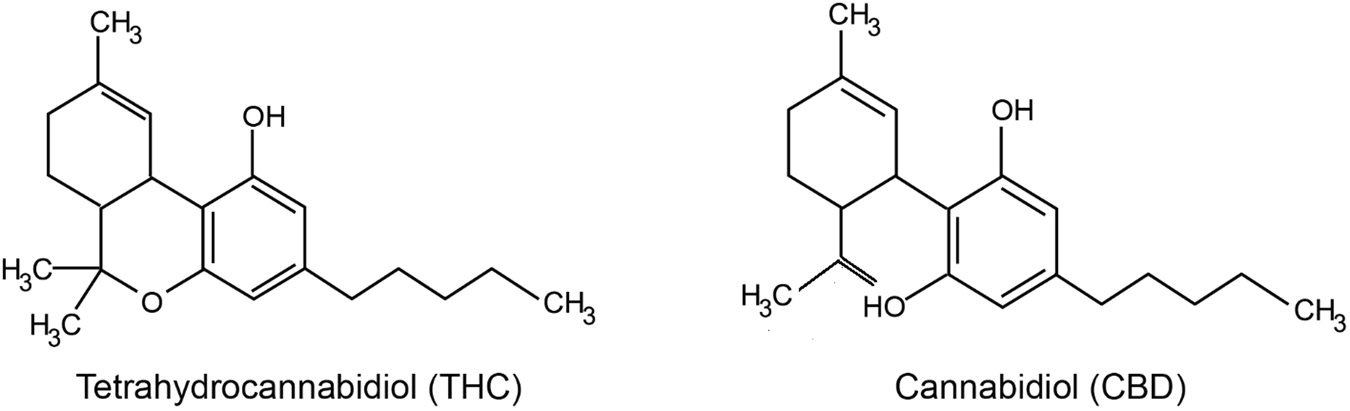
Екзогенні фітоканабіноїди: CBD і THC
Канабіс містить кілька біологічно активних сполук, серед яких найбільш відомими є Δ9-тетрагідроканабінол (THC) та канабідіол (CBD). THC — це головний психоактивний компонент канабісу, який викликає стан ейфорії або "кайфу", водночас виявляючи також анальгезивні, протизапальні, антисудомні, протиблювотні властивості, а також здатність стимулювати апетит (Chayasirisobhon, 2020; Harbich, Michalak, & Michalak, 2024). Основним його механізмом дії є активація рецепторів CB1 — головних канабіноїдних рецепторів центральної нервової системи (Wright, Di Ciano, & Brands, 2020).Сучасні форми використання
Хоча інгаляційні та курильні форми канабісу часто використовуються пацієнтами, вони не стандартизовані як фармацевтичні продукти через значні варіації дози, складні регуляторні обмеження та побоювання з приводу безпеки (Stella et al., 2021).
Єдиним схваленим FDA рослинним канабіноїдом є Epidiolex — пероральний розчин CBD, призначений для лікування епілепсійних синдромів (Stella et al., 2021). Синтетичні аналоги THC — дронобінол і набілон — випускають у вигляді оральних капсул (Stella et al., 2021).
Для зручності пацієнтів та уникнення значного метаболізму печінкою, розробляють орофарінгальні таблетки CBD, що швидко диспергуються в ротовій порожнині. Понад те, трансдермальні гелі, дермальні спреї й наноcферні системи перебувають на стадії клінічних випробувань, забезпечуючи контрольоване вивільнення канабіноїдів без перорального чи інгаляційного шляху введення (Stella et al., 2021).
Традиційні топічні (лініменти) та галенові форми — гелі, олії, креми, мазі — часто містять CBD, THC або інші канабіноїди (наприклад, CBG) у поєднанні з допоміжними речовинами, що покращують проникність через шкіру та стабільність препарату (Kaczorová et al., 2023).


Канабіноїди і тривожність
Тривожні розлади є найпоширенішими психічними захворюваннями у світі, створюючи значні соціальні витрати та економічне навантаження. Вони супроводжуються панічними атаками, поведінкою уникнення та зниженим загальним благополуччям, що призводить до погіршення міжособистісних стосунків, підвищеного рівня безробіття та зростання ризику суїциду (Wright, Di Ciano, & Brands, 2020).
Перші клінічні випробування ще в 1980-х показали, що CBD може зменшувати анксіогенні та психоактивні ефекти THC у здорових добровольців (Wright, Di Ciano, & Brands, 2020).
Нейровізуалізаційні дослідження гострого введення CBD виявили модифікації мозкового кровотоку в ключових структурах, пов’язаних із тривогою: мигдалеподібному тілі, гіпоталамусі, гіпокампі та поясній корі (Wright, Di Ciano, & Brands, 2020).
Таким чином, від доклінічних моделей до перших клінічних та нейровізуалізаційних даних, накопичені свідчення чітко вказують на багатоаспектний анксіолітичний потенціал CBD, який залежить від дози, контексту застосування та цільових нейрональних мереж.
Канабіноїди і ПТСР
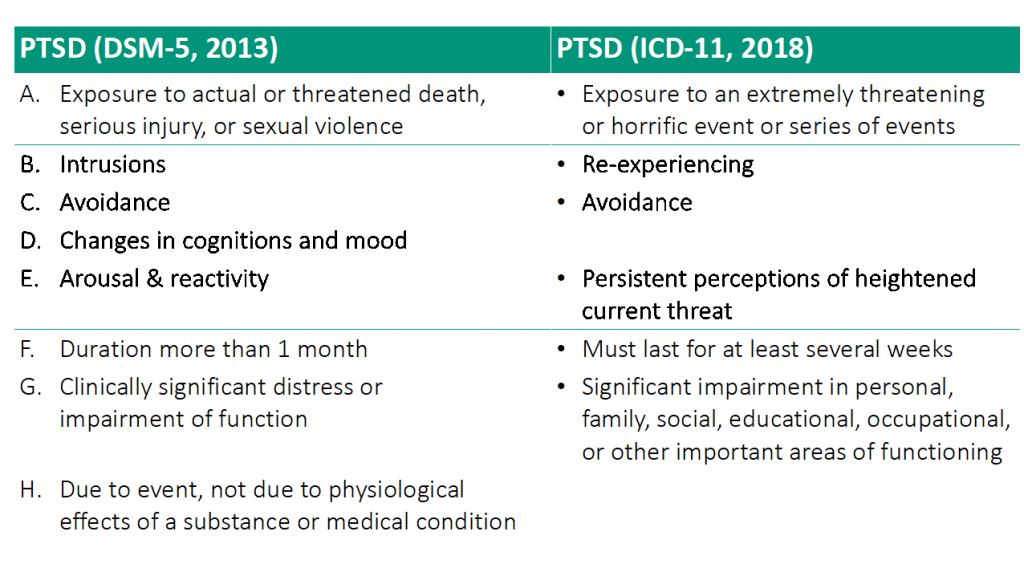
Посттравматичний стресовий розлад (ПТСР) — це хронічний стан, що може розвинутися після переживання травматичної події і проявляється порушеннями сну, когнітивними змінами (наприклад, нав’язливим пригадуванням події), погіршенням настрою, емоційною нестабільністю та зниженням соціальних навичок (Bitencourt & Takahashi, 2018). Нині для лікування ПТСР використовують анксиолітики та антидепресанти, проте їхня ефективність обмежена, а побічні ефекти суттєві (Berger et al., 2009; Shin et al., 2014; Bernardy & Friedman, 2015; Bitencourt & Takahashi, 2018).Обмеження, з якими стикаються науковці й лікарі
Хоча CBD зазвичай вважають добре переносимим, недавній мета-аналіз 1–14-тижневих досліджень продемонстрував, що найчастішими небажаними ефектами (НЕ) є седативний ефект, зниження апетиту, діарея та сонливість, причому тяжчі НЕ частіше спостерігалися за високих доз і в пацієнтів з епілепсією — можливий внесок у це дають лікарсько-лікарські взаємодії з протиепілептичними засобами (Chesney et al., 2020; Gaston et al., 2017; Geffrey et al., 2015; Morrison et al., 2019). У дослідженнях інших показань, де застосовували CBD у здорових добровольців, відмінність від плацебо виявили лише за показником діареї (Chesney et al., 2020).Контроверсійним залишається й питання серотонінових механізмів: Rock et al. (2012) не підтвердили пряму агоністичну дію CBD на 5-HT1A, припустивши аллостеричні або внутрішньоклітинні модифікації; експериментального підтвердження цих механізмів на живих організмах на разі немає (Ibeas Bih et al., 2015).
Отжи, подальші дослідження мають не лише розширити клінічний спектр доз і схем введення CBD, але й з’ясувати його молекулярні мішені та ефекти супроводу, щоби повною мірою оцінити його терапевтичний потенціал у різних психоневрологічних станах.
Психічні виклики під час війни: стрес, тривога, депресія
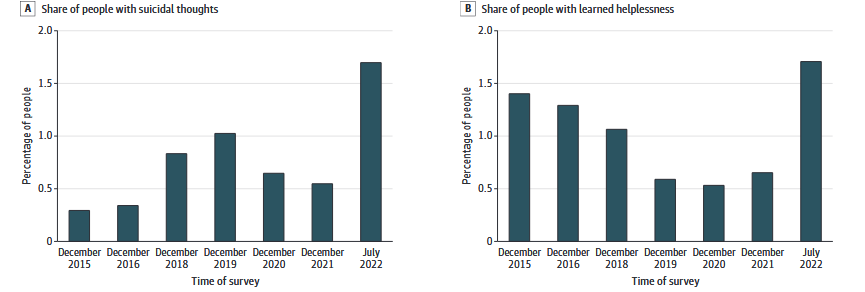
Стрес — це нормальна реакція організму на зовнішні загрози, але в умовах повномасштабного вторгнення його рівень у населення України в середньому сягав 7.55 із 16 можливих балів через шість місяців після початку бойових дій (Kurapov et al., 2023).Досвід інших країн
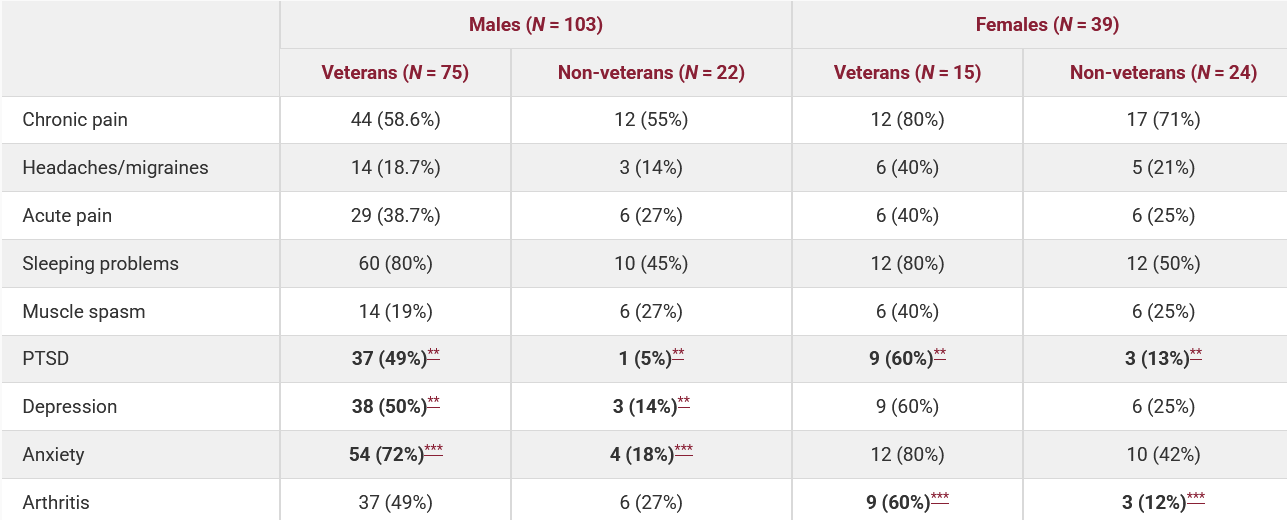
В США питання використання канабісу для лікування ПТСР серед ветеранів досліджено найретельніше. Виявлено, що приблизно 44 % ветеранів із легкими черепно-мозковими травмами вживають канабіс щомісяця — у п’ять разів більше, ніж у загальному населення (8,6 %) (Utter et al., 2023). Серед тих, хто звертається по допомогу, відсоток користувачів канабісу для медичних чи рекреаційних цілей досягає 40–45 % (Betthauser et al., 2015; Metrik, J. Et al, 2018). Хоча перше плацебо-контрольоване дослідження, проведене MAPS, не показало переваги куріння канабісу над плацебо (Bonn-Miller et al., 2021), більш свіжі дані свідчать, що ветерани, які вживали канабіс за рецептом, у 2,5 рази частіше переставали відповідати критеріям діагнозу ПТСР (VFW, 2021). Водночас політика VA забороняє виписувати медичний канабіс через федеральне віднесення його до Списку I, і ветерани вимушені самостійно шукати його в штатних програмах або на нелегальному ринку (Politico, 2021). Лише наприкінці 2024 р. FDA дозволило провести нове плацебо-контрольоване дослідження MJP2 за участю 320 ветеранів для вивчення канабісу з високими концентраціями ТГК в реальних умовах (Stars and Stripes, 2024; The Psychiatrist, 2024).

Водночас у громадян України, які постраждали від війни, проблема доступу до канабісу залишається відкритою. Медичний канабіс легалізували в серпні 2024 р., однак у кінцевому переліку захворювань PTSD виключили, хоча МОЗ оцінює потенційну цільову аудиторію в 6 млн осіб (Business Insider, 2023; Le Monde, 2024; Cannabis Health News, 2024). Кампанія «Cannabis with Ukraine» прагне поширити терапії серед поранених і дітей загиблих, але поки що чітких механізмів забезпечення доступу для мирних громадян немає (Soft Secrets, 2025).
Насамкінець, хоча країни демонструють різний рівень політичної підтримки й наукової бази, загальним викликом залишається збалансування доступності, доказовості ефективності й довгострокової безпеки канабіноїдних терапій для ветеранів і цивільних, постраждалих від бойових дій.
Юридичний і медичний статус канабісу в Україні
16 лютого 2024 року Президент України Володимир Зеленський підписав Закон України №3528-IX «Про внесення змін до деяких законів України щодо державного регулювання обігу рослин роду коноплі (Cannabis)». Закон набув чинності 16 серпня 2024 року, що ознаменувало історичний момент для медичної практики в Україні (Кабінет Міністрів України, 2023; Суспільне, 2025; Укрінформ, 2024).
Законопроєкт №7457, як він був відомий на стадії розгляду, був ухвалений Верховною Радою 21 грудня 2023 року у другому читанні та в цілому, набравши підтримку 248 депутатів. Документ регулює обіг канабісу виключно в медичних, промислових, наукових та науково-технічних цілях, залишаючи рекреаційне використання під забороною (Рада, 2025; BBC Україна, 2023).
МОЗ України затвердило перелік хвороб і станів, за яких призначатиметься медичний канабіс наказом від 13 вересня 2024 року №1586. Перелік заснований на найсучасніших дослідженнях і доказах ефективності та періодично переглядатиметься (МОЗ, 2024; ТСН, 2024).
До затвердженого переліку входять:
Хронічний або нейропатичний біль та/або спастичність, спричинені:- Злоякісними новоутвореннями (C00-C97)
- Діабетичною нейропатією (E10.4-E14.4)
- Розсіяним склерозом (G35)
- Ураженням трійчастого та лицевого нерва (G50, G51)
- Невралгіями внаслідок оперізувального лишаю (G53.0)
- Травмами спинного мозку та внутрішньочерепними травмами
- Церебральним паралічем та іншими паралітичними синдромами
Інші показання включають:
- Нудоту та блювання внаслідок хімієтерапії
- Хворобу Паркінсона та синдром де ля Туретта
- Рефрактерну епілепсію
- Дитячі судомні синдроми (Леннокса-Гасто, Драве, туберозний склероз)
- Втрату ваги при ВІЛ-інфекції
- Інші захворювання за наявності висновку лікарсько-консультативної комісії (МОЗ, 2024; MedPlatforma, 2024).
Ліки на основі медичного канабісу можна отримати виключно за електронним рецептом лікаря первинної або спеціалізованої медичної допомоги. Дані про призначення вносяться до електронної системи охорони здоров'я (ЕСОЗ), що забезпечує повну прозорість процесу (МОЗ, 2024; Громадське радіо, 2025).
Для дітей встановлені особливі обмеження: співвідношення канабідіолу до тетрагідроканабінолу має становити більше 20:1, а максимальна добова доза не може перевищувати 25 мг/кг ваги тіла. Ліки не призначають вагітним, жінкам під час грудного вигодовування та пацієнтам із схильністю до психотичних розладів (The Village, 2025).
У січні 2025 року в Україні офіційно зареєстрували перші ліки на основі медичного канабісу - оральні краплі іспанського бренду "Кураліф". Це стало важливою віхою після багаторічної боротьби пацієнтських організацій за доступ до лікування (Ґвара Медіа, 2025; LB.ua, 2025).
Стигматизація та соціально-правові бар’єри
Найбільша проблема - це нерозуміння і незнання людей щодо відмінностей медичного канабісу від рекреаційного. За словами представників пацієнтських організацій, у суспільстві існує стійка стигма, коли поняття медичного та рекреаційного канабісу навмисне змішуються, що створює непорозуміння щодо безпеки та ефективності медичних препаратів (Укр.радіо, 2024).
Дослідження 2020 року серед українських студентів-фармацевтів показало, що майже половина респондентів були недостатньо поінформовані про терапевтичні властивості канабісу, хоча більше 90% вважали, що матеріали про медичні властивості канабісу мають бути включені в навчальні програми (Kovalenko et al., 2020).
Kovalenko, A., Pakhomov, I., Horoshko, O., Kalinichenko, V., & Bezditko, P. (2020). Perspectives on formation of medical cannabis market in Ukraine based on holistic approach. PMC. https://pmc.ncbi.nlm.nih.gov/articles/PMC7819340/
Пацієнтські організації наполягають на включенні ПТСР до офіційного переліку показань. Наразі цей стан можна лікувати медичним канабісом лише за висновком лікарсько-консультативної комісії у лікарнях з науковою базою, що обмежує доступ для багатьох ветеранів (LB.ua, 2025).
Відсутність належної підготовки медичних працівників створює додаткові перешкоди. Благодійні організації разом з Академією НСЗУ готують онлайн навчання для українських лікарів, щоб вони могли перейняти сучасні схеми лікування закордонних колег (LB.ua, 2025).
Ризики та етичні застереження
За останні роки в Сполучених Штатах канабіс став одним із найпоширеніших психоактивних засобів: за оцінками великого національного опитування, упродовж минулого року ним користувались 52,4 млн осіб віком від 12 років і старше, що становить 18,7 % цієї вікової групи (Le Foll et al., n.d.). Водночас 16,3 млн людей (5,8 % тих же вікових категорій) відповідали клінічним критеріям «розладу, пов’язаного з вживанням канабісу» (CUD) (Le Foll et al., n.d.).
Ці факти мають пояснення в чинниках, які впливають на розвиток залежності. По-перше, чим раніше людина починає вживати канабіс, тим швидше її звичка може перейти у хронічне вживання і врешті в CUD (Le Foll et al., n.d.). По-друге, хоча в чоловіків інцидент CUD за всіма віковими групами зустрічається частіше, деякі дані вказують, що жінки після першого вживання канабісу можуть швидше формувати залежність (Le Foll et al., n.d.).
Епідеміологічні дослідження вказують на те, що вживання канабісу значно підвищує ризик розвитку психотичних розладів. Так, мета-аналіз проспективних робіт показав, що у тих, хто колись пробував канабіс, шанси виникнення психотичного розладу були у 2,58 раза вищими, ніж у тих, хто його не вживав (Moore et al., 2007).

Разом ці результати підкреслюють:
- Канабіс – фактор ризику психозів. Вживання навіть поодиноке підвищує ризик у кілька разів.
- Підлітки – найбільш вразлива група. Розвиток мозку робить їх особливо чутливими до психотогенних ефектів THC.
- Потрібні превентивні заходи. Відтермінування початку вживання та інформування про ризики мають стати пріоритетом у роботі з молоддю.
Канабіс і Україна – замість висновку
Щоб Україна змогла ефективно й безпечно використовувати канабіс в лікуванні психічних (і не тільки) захворювань, нам потрібна комплексна програма досліджень: від доклінічних випробувань фармакологічних властивостей до масштабних клінічних досліджень за участі військових і цивільних. Паралельно необхідно створити чіткі законодавчі правила та стандарти — хто і за якими показаннями може отримати ліки на основі канабісу, як контролюватиметься якість препаратів і запобігатимуть зловживання. Без широкої просвітницької кампанії неможливо досягти довіри суспільства: важливо пояснити громадянам, що терапевтичний канабіс — це не «вільна доступність наркотику», а ретельно регульований медичний засіб із підтвердженою ефективністю та безпекою.
Медики повинні стати провідниками змін, перш ніж призначити пацієнту терапію, вони мають розуміти механізми дії канабіноїдів, вміти оцінити доцільність і ризики для кожного індивідуума. Психологи допоможуть інтегрувати канабіноїдну терапію з психотерапевтичними методиками, посилюючи ефект від обох підходів. Науковці: фармакологи, клінічні дослідники, епідеміологи — мають працювати над безперервним збором даних та вдосконаленням протоколів лікування. У спільній праці цих фахівців народиться надійний, доказовий алгоритм, який мінімізуватиме ризики й забезпечуватиме максимальну користь для пацієнта.
Ветерани та цивільні, які пережили травму війни, часто залишаються поза увагою традиційних систем охорони здоров’я. Медичний канабіс може стати важливим інструментом у зниженні посттравматичної тривоги, покращенні сну та загального самопочуття. Створення спеціалізованих центрів підтримки, де ветерани й постраждалі мирні жителі отримають одночасно медичну, психологічну та соціальну допомогу з можливістю канабіноїдної терапії, може дати новий поштовх у відновленні як окремих людей, так і цілих громад. Така модель поєднання доказової медицини й соціальної реабілітації покаже приклад інтегрованого підходу, здатного реально змінити життя тих, хто віддав здоров’я заради нашої безпеки.
Канабіноїди не є універсальним засобом від усіх психічних страждань, але вони відкривають нові можливості для підтримки тих, хто пережив війну та інші травми, як додатковий інструмент у руках медиків і психотерапевтів. Водночас необхідно знайти золоту середину між жорстким науковим контролем кожного етапу досліджень і гуманістичним прагненням відгукнутися на спільну біль і страждання громадян, не обмежуючись лише протоколами та цифрами. В умовах, коли війна прискорює перегляд наших уявлень про психічне здоров’я і спонукає шукати нетипові шляхи допомоги, саме поєднання доказової медицини та гуманного підходу може стати справжнім каталізатором змін у ставленні суспільства до психоактивних речовин і турботи про психічне здоров’я пацієнта.
Джерела
- Di Marzo, V. (2009). The endocannabinoid system: Its general strategy of action, tools for its pharmacological manipulation and potential therapeutic exploitation. Pharmacological Research, 60(2), 77–84. https://doi.org/10.1016/j.phrs.2009.02.010
- Lu, H. C., & Mackie, K. (2021). An Introduction to the Endogenous Cannabinoid System. Biological Psychiatry, 89(6), 516-525. https://doi.org/10.1016/j.biopsych.2021.01.001
- Wilson, R. I., & Nicoll, R. A. (2002). Endocannabinoid signaling in the brain. Science, 296(5568), 678-682. https://doi.org/10.1126/science.1063545
- Maldonado, R., Valverde, O., & Berrendero, F. (2006). Involvement of the endocannabinoid system in drug addiction. Trends in Neurosciences, 29(4), 225-232. https://doi.org/10.1016/j.tins.2006.01.008
- Sidhpura, N., & Parsons, L. H. (2011). Endocannabinoid-mediated synaptic plasticity and addiction-related behavior. https://doi.org/10.1016/j.neuropharm.2011.05.034
- Bitencourt, R. M., & Takahashi, R. N. (2018). Cannabidiol as a Therapeutic Alternative for Post-traumatic Stress Disorder: From Bench Research to Confirmation in Human Trials. Behavioural Pharmacology, 29(2 and 3‐Spec Issue), 239–251. https://doi.org/10.3389/fnins.2018.00502
- Chayasirisobhon, S. (2020). Mechanisms of action and pharmacokinetics of cannabis. The Permanente Journal, 25, 1–3. https://doi.org/10.7812/TPP/19.200
- Harbich, M. A., Michalak, S. S., & Michalak, L. M. (2024). Understanding Medical Cannabis: A simple guide to CBD and THC. Acta Poloniae Pharmaceutica, 81(3), 595-601. ⦁ https://www.ptfarm.pl/en/wydawnictwa/czasopisma/acta-poloniae-pharmaceutica/110/-/30574)[3]
- Wright, M., Di Ciano, P., & Brands, B. (2020). Use of cannabidiol for the treatment of anxiety: A short synthesis of pre-clinical and clinical evidence. Canadian Journal of Addictions, 11(3), 34–42. https://sgcm-sscm.ch/wp-content/uploads/2024/06/wright_ccr-2020_cbd-anxiety.pdf
- Pertwee, R. G. (2008). Ligands that target cannabinoid receptors in the brain: from THC to anandamide and beyond. Addiction Biology, 13(2), 147–159. https://doi.org/10.1111/j.1369-1600.2008.00108.x
- Bisogno, T., Hanus, L., De Petrocellis, L., Tchilibon, S., Ponde, D. E., Brandi, I., ... & Di Marzo, V. (2001). Molecular targets for cannabidiol and its synthetic analogues: effect on vanilloid VR1 receptors and on the cellular uptake and enzymatic hydrolysis of anandamide. British Journal of Pharmacology, 134(4), 845–852 https://doi.org/10.1038/sj.bjp.0704327
- De Petrocellis, L., Ligresti, A., Moriello, A. S., Allarà, M., Bisogno, T., Petrosino, S., ... & Di Marzo, V. (2011). Effects of cannabinoids and cannabinoid-enriched Cannabis extracts on TRP channels and endocannabinoid metabolic enzymes. British Journal of Pharmacology, 163(7), 1479–1494. https://doi.org/10.1111/j.1476-5381.2010.01166.x
- Leweke, F. M., Piomelli, D., Pahlisch, F., Muhl, D., Gerth, C. W., Hoyer, C., ... & Koethe, D. (2012). Cannabidiol enhances anandamide signaling and alleviates psychotic symptoms of schizophrenia. Translational Psychiatry, 2, e94. https://doi.org/10.1038/tp.2012.15
- Elmes, M. W., Kaczocha, M., Berger, W. T., Leung, K., Ralph, B. P., Wang, L., ... & Deutsch, D. G. (2015). Fatty acid-binding proteins (FABPs) are intracellular carriers for Δ9-tetrahydrocannabinol (THC) and cannabidiol (CBD). Journal of Biological Chemistry, 290(14), 8711–8721. https://doi.org/10.1074/jbc.M114.618447
- Chhatwal, J. P., Davis, M., Maguschak, K. A., & Ressler, K. J. (2005). Enhancing cannabinoid neurotransmission augments the extinction of conditioned fear. Neuropsychopharmacology, 30(3), 516–524. https://doi.org/10.1038/sj.npp.1300624
- Pamplona, F. A., Prediger, R. D., Pandolfo, P., & Takahashi, R. N. (2006). The cannabinoid receptor agonist WIN 55,212-2 facilitates the extinction of contextual fear memory and spatial memory in rats. Psychopharmacology, 188, 641–649. http://dx.doi.org/10.1007/s00213-006-0514-0
- Bitencourt, R. M., & Takahashi, R. N. (2008). Facilitation of contextual fear memory extinction and anti-anxiogenic effects of AM404 and cannabidiol. European Neuropsychopharmacology, 18(12), 849–859. https://doi.org/10.1016/j.euroneuro.2008.07.001
- Bitencourt, R. M., & Takahashi, R. N. (2018). Cannabidiol as a Therapeutic Alternative for Post‐traumatic Stress Disorder: From Bench Research to Confirmation in Human Trials. Frontiers in Neuroscience, 12, 502. https://doi.org/10.3389/fnins.2018.00502
- Russo, E., Burnett, A., Hall, B., & Parker, K. (2005). Agonistic properties of cannabidiol at 5-HT1a receptors. Neurochemical Research, 30(8), 1037–1043. https://doi.org/10.1007/s11064-005-6978-1
- Campos, A. C., & Guimarães, F. S. (2008). Involvement of 5HT1A receptors in the anxiolytic-like effects of cannabidiol injected into the dorsolateral periaqueductal gray of rats. Psychopharmacology, 199(2), 223–230. https://doi.org/10.1007/s00213-008-1168-x
- Gomes, F. V., Resstel, L. B., & Guimarães, F. S. (2011). The anxiolytic-like effects of cannabidiol injected into the bed nucleus of the stria terminalis are mediated by 5-HT1A receptors. Psychopharmacology, 213(2-3), 465–473. https://doi.org/10.1007/s00213-010-2036-z
- Campos, A. C., & Guimarães, F. S. (2009). Evidence for a potential role for TRPV1 receptors in the dorsolateral periaqueductal gray in the attenuation of the anxiolytic effects of cannabinoids. Progress in neuro-psychopharmacology & biological psychiatry, 33(8), 1517–1521. https://doi.org/10.1016/j.pnpbp.2009.08.017
- Campos, A. C., Moreira, F. A., Gomes, F. V., Del Bel, E. A., & Guimarães, F. S. (2012b). Multiple mechanisms involved in the large-spectrum therapeutic potential of cannabidiol in psychiatric disorders. Philosophical Transactions of the Royal Society B: Biological Sciences, 367(1607), 3364–3378. https://doi.org/10.1098/rstb.2011.0389
- Resstel, L. B., Tavares, R. F., Lisboa, S. F., Joca, S. R., Corrêa, F. M., & Guimarães, F. S. (2009). 5-HT1A receptors are involved in the cannabidiol-induced attenuation of behavioural and cardiovascular responses to acute restraint stress in rats. British Journal of Pharmacology, 156(1), 181–188. https://doi.org/10.1111/j.1476-5381.2008.00046.x
- Stella, B., Baratta, F., Della Pepa, C., Arpicco, S., Gastaldi, D., & Dosio, F. (2021). Cannabinoid formulations and delivery systems: Current and future options to treat pain. Drugs, 81(13), 1513–1557. https://doi.org/10.1007/s40265-021-01579-x
- Kaczorová D, Peč J, Béres T, Štefelová N, Ćavar Zeljković S, Trojan V, Janatová AK, Klouček P and Tarkowski P (2023), Phytocannabinoid-rich galenic preparations for topical administration: extraction and stability testing. Front. Pharmacol. 14:1230728. doi: 10.3389/fphar.2023.1230728
- Blessing, E. M., Steenkamp, M. M., Manzanares, J., & Marmar, C. R. (2015). Cannabidiol as a potential treatment for anxiety disorders. Neurotherapeutics, 12(4), 825–836. https://doi.org/10.1007/s13311-015-0387-1
- Lee, J. L. C., Bertoglio, L. J., Guimarães, F. S., & Stevenson, C. W. (2017). Cannabidiol regulation of emotion and emotional memory processing: Relevance for treating anxiety-related and substance abuse disorders. British Journal of Pharmacology, 174(19), 3242–3256. https://doi.org/10.1111/bph.13724
- Papagianni, E. P., & Stevenson, C. W. (2019). Cannabinoid Regulation of Fear and Anxiety: an Update. Current Psychiatry Reports, 21, 38. https://doi.org/10.1007/s11920-019-1026-z
- Bertoglio, Leandro & Carobrez, Antonio. (2016). Animal Tests for Anxiety. Animal models as tools in ethical biomedical research. 271-284. 10.1007/978-3-319-11578-8_18.
- Berger, W., Mendlowicz, M. V., Marques-Portella, C., Kinrys, G., Fontenelle, L. F., Marmar, C. R., & Figueira, I. (2009). Pharmacologic alternatives to antidepressants in posttraumatic stress disorder: a systematic review. Progress in neuro-psychopharmacology & biological psychiatry, 33(2), 169–180. https://doi.org/10.1016/j.pnpbp.2008.12.004
- Shin, L. M., Rauch, S. L., & Pitman, R. K. (2014). Posttraumatic stress disorder: Neuroimaging and neurocircuitry. Neuropsychopharmacology, 39(1), 1–23. https://doi.org/10.1017/S1092852900007306
- Bernardy, N. C., & Friedman, M. J. (2017). Pharmacological management of posttraumatic stress disorder. Current Opinion in Psychology, 14, 116–121. https://doi.org/10.1016/j.copsyc.2017.01.003
- Marsicano, G., Wotjak, C. T., Azad, S. C., Bisogno, T., Rammes, G., Cascio, M. G., ... & Lutz, B. (2002). The endogenous cannabinoid system controls extinction of aversive memories. Nature, 418(6897), 530–534. https://doi.org/10.1038/nature00839
- Quirk, G. J., & Mueller, D. (2008). Neural mechanisms of extinction learning and retrieval. Neuropsychopharmacology, 33(1), 56–72. https://doi.org/10.1038/sj.npp.1301555
- Singewald, N., Schmuckermair, C., Whittle, N., Holmes, A., & Ressler, K. J. (2015). Pharmacology of cognitive enhancers for exposure-based therapy of fear, anxiety and trauma-related disorders. Pharmacology & Therapeutics, 149, 150–190. https://doi.org/10.1016/j.pharmthera.2014.12.004
- Levin, R., Almeida, V., Peres, F. F., Calzavara, M. B., da Silva, N. D., Suiama, M. A., Niigaki, S. T., Zuardi, A. W., Hallak, J. E., Crippa, J. A., & Abílio, V. C. (2012). Antipsychotic profile of cannabidiol and rimonabant in an animal model of emotional context processing in schizophrenia. Current pharmaceutical design, 18(32), 4960–4965. https://doi.org/10.2174/138161212802884735
- Stern, C. A. J., Gazarini, L., Takahashi, R. N., Guimarães, F. S., & Bertoglio, L. J. (2012). On disruption of fear memory by reconsolidation blockade: Evidence from cannabidiol treatment. Neuropsychopharmacology, 37(9), 2132–2142. https://doi.org/10.1038/npp.2012.63
- Bitencourt, R. M., Pamplona, F. A., & Takahashi, R. N. (2008). Facilitation of contextual fear memory extinction and anti-anxiogenic effects of AM404 and cannabidiol. European Neuropsychopharmacology, 18(12), 849–859. https://doi.org/10.1016/j.euroneuro.2008.07.001
- Do Monte, F. H. M., Souza, R. R., Bitencourt, R. M., Kroon, J. A., & Takahashi, R. N. (2013). Infusion of cannabidiol into infralimbic cortex facilitates fear extinction via CB1 receptors. Behavioural Brain Research, 250, 23–27. https://doi.org/10.1016/j.bbr.2013.04.045
- Fusar-Poli, P., Crippa, J. A., Bhattacharyya, S., Borgwardt, S. J., Allen, P., Martin-Santos, R., Seal, M., Surguladze, S. A., O'Carrol, C., Atakan, Z., Zuardi, A. W., & McGuire, P. K. (2009). Distinct effects of {delta}9-tetrahydrocannabinol and cannabidiol on neural activation during emotional processing. Archives of general psychiatry, 66(1), 95–105. https://doi.org/10.1001/archgenpsychiatry.2008.519
- Passie, T., Emrich, H. M., Karst, M., Brandt, S. D., & Halpern, J. H. (2012). Mitigation of post-traumatic stress symptoms by Cannabis resin: A review of the clinical and neurobiological evidence. Drug Testing and Analysis, 4(7–8), 649–659. https://doi.org/10.1002/dta.1377
- Jiang, W., Zhang, Y., Xiao, L., Van Cleemput, J., Ji, S. P., Bai, G., & Zhang, X. (2005). Cannabinoids promote embryonic and adult hippocampus neurogenesis and produce anxiolytic- and antidepressant-like effects. The Journal of clinical investigation, 115(11), 3104–3116. https://doi.org/10.1172/JCI25509
- Monti J. M. (1977). Hypnoticlike effects of cannabidiol in the rat. Psychopharmacology, 55(3), 263–265. https://doi.org/10.1007/BF00497858
- Hsiao, Y. T., Yi, P. L., Li, C. L., & Chang, F. C. (2012). Effect of cannabidiol on sleep disruption induced by the repeated combination tests consisting of open field and elevated plus-maze in rats. Neuropharmacology, 62(1), 373–384. https://doi.org/10.1016/j.neuropharm.2011.08.013
- Chagas, M. H., Eckeli, A. L., Zuardi, A. W., Pena-Pereira, M. A., Sobreira-Neto, M. A., Sobreira, E. T., ... & Crippa, J. A. (2014). Cannabidiol can improve complex sleep-related behaviours associated with rapid eye movement sleep behaviour disorder in Parkinson’s disease patients: A case series. Journal of Clinical Pharmacy and Therapeutics, 39(5), 564–566. https://doi.org/10.1111/jcpt.12177
- Chesney, E., Oliver, D., Green, A., Sovi, S., Wilson, J., Englund, A., & Freeman, T. P. (2020). Adverse effects of cannabidiol: a systematic review and meta-analysis of randomized clinical trials. Neuropsychopharmacology, 45(11), 1799–1806. https://doi.org/10.1038/s41386-020-0661-8
- Gaston, T. E., & Friedman, D. (2017). Pharmacology of cannabinoids in the treatment of epilepsy. Epilepsy & behavior : E&B, 70(Pt B), 313–318. https://doi.org/10.1016/j.yebeh.2016.11.016
- Geffrey, A. L., Pollack, S. F., Bruno, P. L., & Thiele, E. A. (2015). Drug-drug interaction between clobazam and cannabidiol in children with refractory epilepsy. Epilepsia, 56(8), 1230–1236. https://doi.org/10.1111/epi.13063
- Morrison, G., Crockett, J., Blakey, G., & Sommerville, K. (2019). A phase 1, open-label, pharmacokinetic trial to investigate possible drug–drug interactions between cannabidiol and clobazam, stiripentol, or valproate in healthy subjects. Clinical Pharmacology in Drug Development, 8(8), 1009–1031. https://doi.org/10.1002/cpdd.691
- Masataka, N. (2019). Anxiolytic effects of repeated cannabidiol treatment in teenagers with social anxiety disorders. Frontiers in Psychology, 10, 2466. https://doi.org/10.3389/fpsyg.2019.02466
- Arndt, D. L., & de Wit, H. (2017). Cannabidiol does not dampen responses to emotional stimuli in healthy adults. Cannabis and Cannabinoid Research, 2(1), 105–113. https://doi.org/10.1089/can.2017.0016
- Ibeas Bih, C., Chen, T., Nunn, A. V., Bazelot, M., Dallas, M., & Whalley, B. J. (2015). Molecular targets of cannabidiol in neurological disorders. Neurotherapeutics, 12(4), 699–730. https://doi.org/10.1007/s13311-015-0377-3
- Cascio, M. G., Anavi-Goffer, S., Fletcher, P. J., Mechoulam, R., Pertwee, R. G., & Parker, L. A. (2012). Cannabidiol, a non-psychotropic component of cannabis, attenuates vomiting and nausea-like behaviour via indirect agonism of 5-HT(1A) somatodendritic autoreceptors in the dorsal raphe nucleus. British journal of pharmacology, 165(8), 2620–2634. https://doi.org/10.1111/j.1476-5381.2011.01621.x
- Brandon Utter, C Alan Anderson, Christopher M Filley, James P Kelly, Catharine Johnston-Brooks, David B Arciniegas, Cannabis Use in a Cohort of Healthcare-Seeking United States Military Veterans With Persisting Symptoms After Mild Traumatic Brain Injury: Preliminary Observations, Military Medicine, Volume 188, Issue 7-8, July/August 2023, Pages e2158–e2164, https://doi.org/10.1093/milmed/usac011
- Betthauser, K., Pilz, J., & Vollmer, L. E. (2015). Use and effects of cannabinoids in military veterans with posttraumatic stress disorder. American Journal of Health-System Pharmacy, 72(15), 1279-1284. https://doi.org/10.2146/ajhp140523
- Jackson, K. M., & Borsari, B. (2018). Medicinal versus Recreational Cannabis Use among Returning Veterans. Translational issues in psychological science, 4(1), 6–20. https://doi.org/10.1037/tps0000133
- Bonn-Miller, M. O., Sisley, S., Riggs, P., Yazar-Klosinski, B., Wang, J. B., Loflin, M. J., Shechet, B., Hennigan, C., Matthews, R., DeWitt, A., & Doblin, R. (2021). The short-term impact of 3 smoked cannabis preparations versus placebo on PTSD symptoms: A randomized cross-over clinical trial. PLoS One, 16(3), e0246990. https://doi.org/10.1371/journal.pone.0246990
- VFW. (2021, September 21). Federal study finds cannabis beneficial for PTSD treatment. VFW. https://www.vfw.org/media-and-events/latest-releases/archives/2021/9/federal-study-finds-cannabis-beneficial-for-ptsd-treatment
- Politico. (2021, November 8). VA rejects cannabis research as veterans plead for medical pot. Politico. https://www.politico.com/news/2021/11/08/va-reject-medical-marijuana-veterans-519757
- Stars and Stripes. (2024, November 22). FDA authorizes clinical trials to study cannabis use for veterans with PTSD. Stars and Stripes. https://www.stripes.com/veterans/2024-11-22/veterans-marijuana-ptsd-trials-fda-15935021.html
- The Psychiatrist. (2024, December 9). FDA approves cannabis study for veterans with PTSD. The Psychiatrist. https://www.psychiatrist.com/news/fda-approves-cannabis-study-for-veterans-with-ptsd/
- Yakirevich Amir, N., Treves, N., Davidson, E., Bonne, O., & Matok, I. (2023). Medical cannabis use among patients with Post-Traumatic Stress Disorder (PTSD): A nationwide database study. European Psychiatry, 66(Suppl 1), S111–S112. https://doi.org/10.1192/j.eurpsy.2023.306
- Globes. (2025, January 9). Is medical cannabis effective in treating PTSD? Globes. https://www.globes.co.il/news/article.aspx?did=1001499062
- Clinical Trial. (2022, February 16). Clinical trial highlights positive effects of medical cannabis on PTSD. MedPath. https://trial.medpath.com/news/ab2258ab47d5f3d9/clinical-trial-highlights-positive-effects-of-medical-cannabis-on-ptsd
- NoCamels. (2023, February 16). Smoke free: Israeli veterans get cannabis inhaler. NoCamels. https://nocamels.com/2023/02/smoke-free-israeli-veterans-get-cannabis-inhaler/
- Syqe Medical. (2025, February 20). Syqe Medical announces agreement with Israeli Ministry of Defence to provide the SyqeAir technology to veterans. Syqe Medical. https://syqe.com/syqe-medical-announces-agreement-with-israeli-ministry-of-defence-to-provide-the-syqeair-technology-to-veterans/
- Veterans Affairs Canada. (2025, April 29). Cannabis for medical purposes. Veterans Affairs Canada. https://www.veterans.gc.ca/en/about-vac/reports-policies-and-legislation/departmental-reports/cannabis-medical-purposes
- Walsh, Z., Gonzalez, R., Crosby, K., Thiessen, M. S., Carroll, C., & Bonn-Miller, M. O. (2017). Medical cannabis and mental health: A guided systematic review. Clinical Psychology Review, 51, 15-29. https://doi.org/10.1016/j.cpr.2016.10.002
- Valikhanova, G., Kato, Y., Fitzcharles, M. A., Ware, M., Da Costa, D., Lowensteyn, I., Cheung, H. S., & Grover, S. (2023). Medical Cannabis Use Among Canadian Veterans and Non-Veterans: A National Survey. Integrative medicine reports, 2(1), 120–128. https://doi.org/10.1089/imr.2023.0022
- Mental Health Commission of Canada. (2023, February 22). Veterans and their families want better research and clinical support on cannabis as a treatment option for their mental health. Mental Health Commission of Canada. https://mentalhealthcommission.ca/news-releases/56112-veterans-and-their-families-want-better-research-and-clinical-support-on-cannabis-as-a-treatment-option-for-their-mental-health/
- Business Insider. (2023, December 22). Ukraine is legalizing medicinal marijuana to treat stress and cancer caused by war. Business Insider. https://www.businessinsider.com/ukraine-legalize-marijuana-cannabis-medicinal-ptsd-cancer-war-2023-12
- Le Monde. (2024, September 14). Ukraine's legalization of medical cannabis is a source of hope for veterans. Le Monde. https://www.lemonde.fr/en/international/article/2024/09/14/ukraine-s-legalization-of-medical-cannabis-is-a-source-of-hope-for-veterans_6726042_4.html
- Cannabis Health News. (2024, October 9). Ukraine excludes PTSD from list of conditions for medical cannabis. Cannabis Health News. https://cannabishealthnews.co.uk/2024/10/09/ukraine-excludes-ptsd-from-list-of-approved-conditions-for-medical-cannabis/ Soft Secrets. (2025, May 1).
- Cannabis in times of war. Soft Secrets. https://softsecrets.com/en-US/article/cannabis-times-war
- BBC Україна. (2023, грудень 21). Канабіс легалізували в Україні. Як отримати ліки. BBC News Україна. https://www.bbc.com/ukrainian/articles/cw4kwv45z51o
- Ґвара Медіа. (2025, січень 8). У 2025 році в Україні з'являться перші ліки з канabісу. Ґвара Медіа. https://gwaramedia.com/u-2025-roczi-v-ukrayini-zyavlyatsya-pershi-liki-z-kanabisu/
- Громадське радіо. (2025, січень 9). Як отримати ліки на основі медканабісу. Громадське радіо. https://hromadske.radio/news/2025/01/09/yak-otrymaty-liky-na-osnovi-medkanabisu
- Кабінет Міністрів України. (2023, грудень 21). Парламент ухвалив законопроект № 7457 про використання в медицині ліків на основі канабісу. Урядовий портал. https://www.kmu.gov.ua/news/parlament-ukhvalyv-zakonoproekt-7457-pro-vykorystannia-v-medytsyni-likiv-na-osnovi-kanabisu
- КМУ. (2025, січень 1). Уряд затвердив ліцензійні умови, що врегульовують обіг медичного канабісу на всіх етапах. Урядовий портал. https://www.kmu.gov.ua/news/uriad-zatverdyv-litsenziini-umovy-shcho-vrehulovuiut-obih-medychnoho-kanabisu-na-vsikh-etapakh
- Kovalenko, A., Pakhomov, I., Horoshko, O., Kalinichenko, V., & Bezditko, P. (2020). Perspectives on formation of medical cannabis market in Ukraine based on holistic approach. PMC. https://pmc.ncbi.nlm.nih.gov/articles/PMC7819340/
- LB.ua. (2025, січень 8). В Україні зареєстровані перші ліки з канабісу. LB.ua. https://lb.ua/health/2025/01/08/654295_ukraini_zareiestrovani_pershi_liki_z.html
- Life.pravda. (2025, лютий 11). Медичний канабіс в Україні: що вже змінилося для пацієнтів та бізнесу. Українська правда. Життя. https://life.pravda.com.ua/society/medichniy-kanabis-v-ukrajini-shcho-vzhe-zminilosya-dlya-paciyentiv-ta-biznesu-306383/
- MedPlatforma. (2024, жовтень 1). МОЗ затвердило перелік хвороб і станів, за яких призначати медичний канабіс. MedPlatforma. https://medplatforma.com.ua/news/83598-moz-zatverdilo-perelik-khvorob-i-staniv-za-yakikh-priznachati-medichniy-kanabis
- МОЗ. (2024, серпень 16). Медичний канабіс. Міністерство охорони здоров'я України. https://moz.gov.ua/uk/medichnij-kanabis
- МОЗ. (2024, вересень 27). МОЗ затвердило перелік хвороб і станів, за яких призначатиметься медичний канабіс. Міністерство охорони здоров'я України. https://moz.gov.ua/uk/moz-zatverdilo-perelik-hvorob-i-staniv-za-yakih-priznachatimetsya-medichnij-kanabis
- МОЗ. (2024, листопад 5). Медичний канабіс: уряд визначив терміни подання заяв на отримання квот у 2025 році. Міністерство охорони здоров'я України. https://moz.gov.ua/uk/medichnij-kanabis-uryad-viznachiv-termini-podannya-zayav-na-otrimannya-kvot-u-2025-roci
- Рада. (2025, серпень 1). Михайло Радуцький: В Україні легалізовано винятково медичний канабіс. Верховна Рада України. https://www.rada.gov.ua/news/news_kom/245144.html
- Studfreedom. (2023, грудень 1). Медичному канабісу — бути чи не бути? Student Freedom. https://studfreedom.org/ua/medychnomu-kanabisu-buty-chy-ne-buty/
- Суспільне. (2024, серпень 16). Легалізація медичного канабісу: що зміниться для тих, хто його потребуватиме. Суспільне мовлення. https://suspilne.media/uzhhorod/815131-legalizacia-medicnogo-kanabisu-so-zminitsa-dla-tih-hto-jogo-potrebuvatime/
- Суспільне. (2025, червень 3). В Україні вперше видали дозвіл на ввезення медичного канабісу. Суспільне мовлення. https://suspilne.media/1033787-v-ukraini-vperse-vidali-dozvil-na-vvezenna-medicnogo-kanabisu/
- ТСН. (2024, вересень 27). За яких хвороб українцям призначатимуть медичний канабіс. ТСН. https://tsn.ua/zdorovya/za-yakih-hvorob-ukrayincyam-priznachatimut-medichniy-kanabis-moz-2668695.html
- The Village. (2025, квітень 5). МОЗ затвердило перелік хвороб і станів, за яких призначатимуть медичний канабіс. The Village Україна. https://www.village.com.ua/village/life/edu-news/355295-moz-zatverdilo-perelik-hvorob-i-staniv-za-yakih-priznachatimut-medichniy-kanabis
- Укр.радіо. (2024, серпень 19). До кінця року можна буде отримати перші ліки – Нікель про медичний канабіс. Українське радіо. https://ukr.radio/news.html?newsID=105081
- Укрінформ. (2024, серпень 16). В Україні почав діяти закон про легалізацію медичного канабісу. Укрінформ. https://www.ukrinform.ua/rubric-society/3895695-v-ukraini-pocav-diati-zakon-pro-legalizaciu-medicnogo-kanabisu.html
- УНІАН. (2023, липень 7). МОЗ підтримує легалізацію в Україні медичного канабісу. УНІАН. https://www.unian.ua/health/legalizaciya-medichnogo-kanabisu-moz-pidtrimav-ideyu-12320427.html
- Le Foll, B., et al. (2024). Cannabis use disorder: from neurobiology to treatment. The Journal of Clinical Investigation, 134(20): e172887. https://doi.org/10.1172/JCI172887.
- Moore, T. H. M., Zammit, S., Lingford-Hughes, A., Barnes, T. R. E., Jones, P. B., Burke, M., & Lewis, G. (2007). Cannabis use and risk of psychotic or affective mental health outcomes: A systematic review. The Lancet, 370(9584), 319–328. https://doi.org/10.1016/S0140-6736(07)60959-6
- Lubman, D. I., Cheetham, A., & Yücel, M. (2015). Cannabis and adolescent brain development. Pharmacology & therapeutics, 148, 1–16. https://doi.org/10.1016/j.pharmthera.2014.11.009
- McDonald, A. J., Kurdyak, P., Rehm, J., Roerecke, M., & Bondy, S. J. (2024). Age-dependent association of cannabis use with risk of psychotic disorder. Psychological medicine, 54(11), 2926–2936. https://doi.org/10.1017/S0033291724000990